 关注我们
关注我们


2024年7月6日,乳腺科廖宁教授课题组在Nature Communications (中科院一区Top期刊)在线发表题为“An in-situ peptide-antibody self-assembly to block CD47 and CD24 signaling enhances macrophage-mediated phagocytosis and anti-tumor immune responses”的研究论文,该研究构建了一种肽-抗体组合-超分子原位组装的CD47和CD24双靶抑制剂(PAC-SABI),其通过配体-受体结合和酶催化反应在癌细胞膜上进行仿生表面增殖,为临床中实体瘤的先天性免疫治疗提供新的思路和实验基础。

巨噬细胞功能调控为实体瘤免疫治疗提供新的思路
靶向程序性细胞死亡蛋白1(PD-1)或其配体程序性死亡配体1(PD-L1)的适应性免疫检查点抑制剂通过破坏抑制性T细胞通路,在某些癌症的治疗中显示出较好效果。然而,其对免疫静止期肿瘤(如乳腺癌和胰腺癌)的效果仍然有限。巨噬细胞作为肿瘤微环境中的关键组成部分,通过吞噬作用、抗原呈递和炎性细胞因子产生,发挥重要的先天免疫作用。然而,癌细胞可以通过上调抗吞噬细胞“不要吃我”的膜蛋白表达来逃避巨噬细胞清除。重新激活先天细胞,特别是巨噬细胞的靶向免疫调节,为完善适应性免疫疗法带来了巨大希望。目前,仍缺乏在实体瘤中阻断巨噬细胞吞噬检查点抑制剂的有效方法。
省医团队构建新型先天性免疫检查点抑制剂
永乐高ylg官网乳腺科主任廖宁教授和张玮琪博士团队原创性开发了一种肽-抗体组合-超分子原位组装的CD47和CD24双靶抑制剂(PAC-SABIs),以刺激巨噬细胞对恶性细胞的吞噬活性,从而引发有效的抗肿瘤免疫(图1)。PAC-SABIs能够在癌细胞膜上进行仿生、配体导向的表面增殖,通过靶标结合和酶催化介导的构象成熟,实现原位自组装和生物活性基序的呈递。团队设计的模块化系统表明,响应性微观结构能够实现细致的分子操作,实现了效果更好的多功能肽抗体疗法。该研究确定超分子肽工程是一种简单而强大的方法,能够将多靶向性、可编程性和空间控制融合在一个单一的纳米级平台中,推动了下一代免疫疗法的发展。
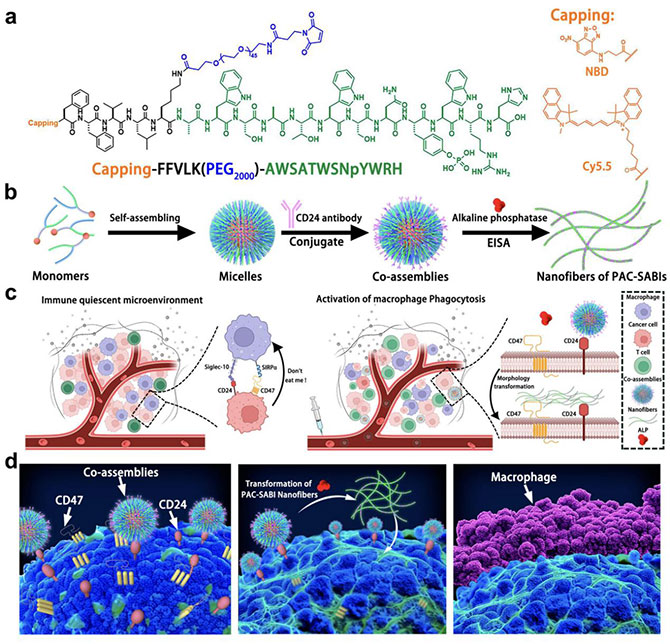
图1.PAC-SABIs的设计及作用机理
该研究由永乐高ylg官网乳腺科廖宁教授课题组、珠江医院蔡延滨教授课题组和南方医院战捷副教授课题组合作完成。第一作者张玮琪博士完成了实验设计、实施和数据分析。西湖大学王怀民教授和松山湖材料实验室张晔教授对本文提供了宝贵的建议和帮助。
张玮琪